Sifat Fisika & Sifat Kimia Zat
BAB I
PENDAHULUAN
A. Latar Belakang
Ada begitu banyak benda di sekeliling kita, baik benda yang berwujud benda padat, cair, maupun gas. Kita sering membedakan benda berdasarkan perbedaan wujudnya.
Akan tetapi, kita juga dapat membedakan benda berdasarkan sifat kimianya. Manusia telah mempelajari berbagai sifat benda, baik ditinjau dari sifat fisis maupun sifat kimia. Dengan mengetahui sifat-sifat benda manusia dapat memanfaatkannya untuk keperluan hidup sehari-hari.
Pelat besi dan baja sekilas tampak sama. Akan tetapi, jika kita bengkokkan, besi akan membengkok, sedangkan baja akan patah. Ini merupakan sifat fisis pelat besi dan baja. Setelah mengetahui sifat-sifat fisis pelat, orang membuat campuran dan baja untuk membuat peralatan tertentu. Campuran besi dan baja ini merupakan bahan yang kuat karena mengandung baja, tetapi jugg lentur karena mengandung besi. Pada pencampuran besi dan baja ini, hanya terjadi perubahan fisis dan tidak ada perubahan kimia.
B. Rumusan Masalah
Dalam penyusunan makalah yang berjudul “Sifat Fisis dan Sifat Kimia Zat“, pen ulis dapat merumuskan masalahnya sebagai berikut:
1. Apakah ada perbedaan antara sifat fisis dengan sifat kimia zat?
2. Apakah ada perbedaan antara perubahan fisis dan perubahan kimia?
3. Apakah ada cara untuk memisahkan campuran?
C. Tujuan Penulisan
Adapun tujuan penulisan makalah ini adalah sebagai berikut :
1. Untuk mengetahui perbedaan antara sifat fisis dengan sifat kimia zat.
2. Untuk mengetahui perbedaan perubahan fisis dan perubahan kimia.
3. Untuk mengetahui cara memisahkan campuran.
BAB II
PEMBAHASAN
A. Perbedaan antara Sifat Fisis dan Sifat Kimia Zat
- Sifat Fisis
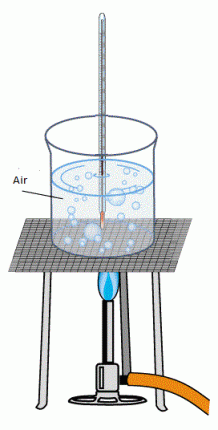
Sifat fisis adalah sifat yang dapat diukur dan diteliti tanpa mengubah komposisi atau susunan dari zat tersebut. Sebagai contoh, kita dapat mengukur titik leleh dari es dengan memanaskan sebuah balok es dan mencatat pada suhu berapa es tersebut berubah menjadi air. Air dengan es hanya berbeda dalam hal penampilan saja, bukan dalam komposisi, jadi ini termasuk kedalam perubahan fisis. Demikian juga bila kita membekukan air tersebut kembali menjadi es seperti mula-mula. Karena itu, titik leleh dari suatu zat termasuk kedalam sifat fisisnya. Sama halnya bila kita mengatakan Helium lebih ringan daripada udara, kita mereferensikannya pada sifat fisis helium tersebut.
Berdasarkan Sifat Fisis atau Fisika, zat diidentifikasikan menjadi dua, yaitu:
1. Sifat ekstensif. Sifat ini adalah sifat yang didasari atas jumlah dan ukurannya atau sifat zat yang dapat dibedakan menurut jumlah dan ukurannya. Misalnya panjang zat, volume zat, dan lain-lain. Jika ukuran zat berubah maka panjangnya juga berubah, begitu pula dengan volumenya.
2. Sifat intensif. Sifat ini tidak dipengaruhi oleh jumlah dan ukurannya. Misalnya massa zat, jenis zat dan lain-lain. Sebesar dan sebanyak berapapun zat itu, massanya tidak berubah, jenisnya juga tidak berubah.
- Sifat Kimia Zat
Sifat kimia adalah sifat yang untuk mengukurnya diperlukan perubahan kimiawi.Sebagai contoh, pernyataan yang menyebutkan bahwa “Gas hidrogen terbakar oleh gas oksigen dan membentuk air” yang mendeskripsikan sifat kimia dari hidrogen, karena untuk menyelidikinya kita harus melakukan perubahan kimiawi, dalam hal ini pembakaran. Setelah terjadi perubahan kimiawi, zat mula-mula, yakni Hidrogen, menghilang dan berubah menjadi zat kimia lain-air. Kita tidak dapat mengembalikan Hidrogen dari air sebagaimana perubahan-perubahan fisis seperti pelelehan atau pembekuan. Contoh lain dari sifat kimia zat adalah dapat terbakar, dapat berkarat, dll.
B. Perbedaan antara Perubahan Fisis dan Perubahan Kimia
1. Perubahan Fisis
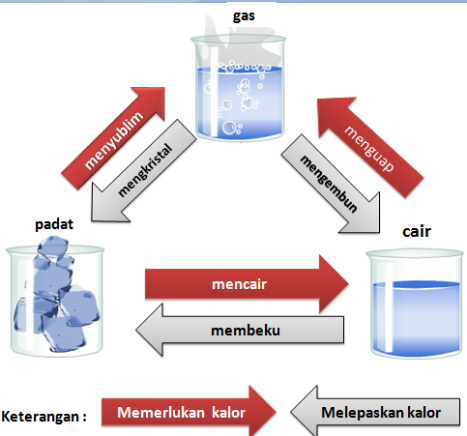
Perubahan fisis adalah perubahan yang merubah suatu zat dalam hal bentuk, wujud atau ukuran, tetapi tidak merubah zat tersebut menjadi zat baru. Contoh perubahan fisis :
a. perubahan wujud
- es balok yang mencair menjadi air
- air menguap menjadi uap
- kapur barus menyublim menjadi gas, dsb
b. perubahan bentuk
- gandum yang digiling menjadi tepung terigu
- benang diubah menjadi kain
- batang pohon dipotong-potong jadi kayu balok dan triplek, dll
c. perubahan rasa berdasarkan alat indera
- perubahan suhu
- perubahan rasa, dan lain sebagainya
- es balok yang mencair menjadi air
- air menguap menjadi uap
- kapur barus menyublim menjadi gas, dsb
b. perubahan bentuk
- gandum yang digiling menjadi tepung terigu
- benang diubah menjadi kain
- batang pohon dipotong-potong jadi kayu balok dan triplek, dll
c. perubahan rasa berdasarkan alat indera
- perubahan suhu
- perubahan rasa, dan lain sebagainya
2. Perubahan Kimia
Perubahan kimia adalah perubahan suatu zat yang menghasilkan zat baru yang berbeda dengan sifat zat asalnya. Perubahan kimia juga disebut perubahan wujud yang terjadi karena reaksi kimia. Contoh-contoh perubahan kimia dalam kehidupan sehari-hari adalah:
1. Kertas yang dibakar menjadi abu
2. Minyak goreng yeng telah teroksidasi dan menjadi tengik
3. Besi yang ditaruh di tanah menjadi berkarat
4. Kayu yang dibakar untuk memasak
5. Barang-barang yang telah kadaluwarsa, dan lain-lain.
Yang perlu digarisbawahi dalam perubahan kimia (reaksi kimia), massa zat tidak pernah berubah (tetap). Menurut Antonie Laurent de Lavoisier (1743-1794), Massa zat-zat yang bereaksi sebelum dan sesudah reaksi terjadi tidak berubah. Hukum Lavoisier ini dikenal dengan hukum kekekalan massa. Menurut pandangan fisika modern hukum kekekalan massa tidak berlaku jika kecepatan zat mendekati kecepatan cahaya (akan dibahas pada materi fisika modern).
C. Cara Pemisahan Campuran
Campuran tersusun dari dua zat atau lebih. Sebagai contoh, air laut tersusun dari air, garam, dan zat padat terlarut lainnya. Susu tersusun dari, lemak dan zat padat lain yang terlarut.
Kita telah mengetahui bahwa campuran terbentuk dari gabungan beberapa macam unsur dan senyawa. Oleh karena itu, untuk memisahkan komponen-komponen penyusun campuran dapat dilakukan dengan berbagai cara sesuai karakteristik sifat zat-zat penyusunnya. Pemisahan komponen-komponen penyusun campuran dapat dipisahkan dengan beberapa cara, yakni penyaringan, destilasi, sublimasi, kristalisasi, dan kromatografi.
1. Penyaringan (Filtrasi)
Pemisahan dengan cara filtrasi bertujuan untuk memisahkan zat padat dari zat cair dalam suatu campuran berdasarkan perbdaningan wujudnya. Alat yang kita gunakan untuk menyaring disebut penyaring. Ukuran penyaring disesuaikan dengan ukuran zat yang akan disaring. Sebagai contoh, pemisahan pasir dan kerikil tentu membutuhkan saringan yang berbeda dengan saringan yang digunakan untuk menyaring tepung.
Zat-zat yang mempunyai perbedaan kelarutan seperti garam kotor ternyata dapat dipisahkan dengan cara penyaringan. Garam dapur yang bercampur dengan kotoran kita larutkan dalam air, kemudian kita saring. Kotoran akan tertinggal dalam kertas saring, sedangkan garam yang larut dalam air masuk menembus kertas saring. Zat yang tertinggal dalam kertas saring disebut residu, sedangkan cairan yang dapat menembus kertas saring disebut filtrat.
2. Destilasi
Destilasi atau penyulingan adalah suatu cara pemisahan campuran yang didasarkan pada perbedaan titik didih komponen-komponen penyusun campuran. Jadi, destilasi ini digunakan untuk memisahkan campuran dari dua atau lebih cairan yang mempunyai titik didih berbeda.
Pemisahan spiritus yang bercampur dengan air dapat dilakukan dengan cara destilasi. Campuran spiritus dengan air kita masukkan dalam labu destilasi, kemudian dipanaskan. Proses yang terjadi adalah campuran air dan spiritus dipanaskan hingga suhu 80oC sehingga spiritus menguap sedang air belum menguap. Uap spiritus didinginkan dalam pendingin Liebieg, sehingga mengembun dan menetes di tabung erlenmeyer. Zat yang dihasilkan dari destilasi yang disebut destilat. Salah satu contoh destilasi terbesar saat ini adalah proses pengolahan minyak bumi menjadi fraksi-fraksi minyak bumi, seperti LPG, bensin, minyak tanah, solar, pelumas, dan aspal.
3. Pengkristalan (Kristalisasi)
Kristalisasi ini banyak dilakukan oleh para pembuat garam/petani garam. Garam dihasilkan melalui cara menguapkan air laut. Prosesnya sederhana, yaitu sebagai berikut. Mula-mula air laut dialirkan ke tambak-tambak dan dibiarkan menguap karena panas matahari hingga beberapa hari. Setelah semua air menguap, akan dihasilkan kristal-kristal garam.
4. Sublimisasi
Sublimisasi adalah perubahan zat dari wujud padat ke gas atau sebaliknya. Pemisahan campuran dengan sublimisasi dilakukan bila zat yang dapat menyublim (misalnya kapur barus/ kamfer) tercampur dengan zat lain yang tidak dapat menyublim (misalnya arang). Contoh benda yang dapat mengalami sublimasi adalah kapur barus (kamper), iodin, dan amonium klorida.
Misalnya, jika iodin terkena kotoran, iodin dapat dipisahkan dari semua kotorannyadengan metode sunlimasi. Iodin kotor dipanaskan dengan panas api kecil sehingga iodin akan menyumblim menjadi gas, sedangkan kotorannya tetap tinggal di dasar bejana. Setelah gas iodin ini menyumblim menjadi padat kembali, maka iodin telah menjadi murni.
5. Kromatografi
Pemisahan campuran dengan cara kromatografi didasarkan pada perbedaan kecepatan merambat antara partikel-partikel zat yang bercampur pada medium tertentu. Contoh pemisahan secara kromatografi adalah rembesan air pada dinding yang menghasilkan garis-garis dengan jarak tertentu. Penerapan kromatografi antara lain untuk memisahkan dan mengidentifikasi zat-zat yang kompleks dari zat warna, minuman beralkohol, dan pestisida.
BAB III
PENUTUP
A. Kesimpulan
Dari pembahasan di atas dapat ditarik kesimpulan bahwa Sifat Fisis adalah sifat yang dapat diukur dan diteliti tanpa mengubah komposisi atau susunan dari zat tersebut, sedangkan sifat kimia zat adalah sifat yang untuk mengukurnya diperlukan perubahan kimiawi. Perubahan fisis adalah perubahan yang merubah suatu zat dalam hal bentuk, wujud atau ukuran, tetapi tidak merubah zat tersebut menjadi zat baru, sedangkan perubahan kimia adalah perubahan suatu zat yang menghasilkan zat baru yang berbeda dengan sifat zat asalnya. Pemisahan dapat dilakukan dengan cara penyaringan (filtrasi), destilasi, kristalisasi, sublimasi dan kromatografi.
B. Saran
Dengan terselesainya makalah ini, penulis berharap agar penyusunan makalah ini dapat bermanfaat bagi pembaca pada umumnya.
Penulis sangat berharap kepada para pembaca setelah membaca makalah ini, dapat meningkatkan potensi pembaca dalam pengolahan zat sehingga dapat memperoleh keuntungan yang maksimal. Mengingat begitu banyaknya zat yang terkandung di dalam bumi ini, penulis berharap generasi muda dapat memanfaatkan berbagai macam zat yang terkandung di dalam bumi kita ini, sehingga dapat meningkatkan potensi intelektulanya di dalam bidang industri.